Графит, молекулярная формула: C, молекулярная масса: 12,01, представляет собой форму элемента углерода, каждый атом углерода связан с тремя другими атомами углерода (расположенными в сотовых шестиугольниках), образуя ковалентную молекулу. Поскольку каждый атом углерода испускает электрон, который может свободно двигаться, графит является проводником.
Графит — один из самых мягких минералов, и его применение включает изготовление грифелей для карандашей и смазочных материалов. Углерод — неметаллический элемент, расположенный во втором цикле IVA группы периодической таблицы. Графит образуется при высоких температурах.
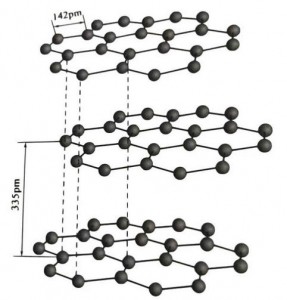
Графит — кристаллический минерал углеродных элементов, его кристаллическая решетка представляет собой гексагональную слоистую структуру. Расстояние между каждым слоем сетки составляет 3,35 А, а расстояние между атомами углерода в одном слое сетки — 1,42 А. Это гексагональная кристаллическая система с полным слоистым спайностью. Поверхность расщепления состоит в основном из молекулярных связей, менее привлекательных для молекул, поэтому ее естественная плавучесть очень хороша.
В кристаллах графита атомы углерода в одном слое образуют ковалентную связь с sp2-гибридизацией, причем каждый атом углерода связан с тремя другими атомами тремя ковалентными связями. Шесть атомов углерода образуют шестинепрерывное кольцо в одной плоскости, переходящее в ламельную структуру, где длина связи CC составляет 142 мкм, что точно находится в пределах диапазона длин связей атомного кристалла, поэтому для того же слоя , это атомный кристалл. Атомы углерода в одной плоскости имеют одну p-орбиту, которая перекрывает друг друга. Электроны относительно свободны, что эквивалентно свободным электронам в металлах, поэтому графит может проводить тепло и электричество, что характерно для металлических кристаллов. Таким образом, их также классифицируют как металлические кристаллы.
Средний слой кристалла графита разделен на 335 пм, и расстояние большое. Она сочетается с силой Ван-дер-Ваальса, то есть слой принадлежит молекулярному кристаллу. Однако поскольку связь атомов углерода в одном плоском слое очень прочная и ее чрезвычайно трудно разрушить, температура растворения графита также очень высока, а его химические свойства стабильны.
Из-за особого способа соединения графит не может рассматриваться как монокристалл или поликристалл, поэтому в настоящее время его обычно рассматривают как смешанный кристалл.
Время публикации: 31 июля 2023 г.